1.細胞老化の分子機構の解析
細胞老化は、動物組織を構成する体細胞が種々のストレスに曝された際に、分裂能力を不可逆的に喪失する現象である。老化細胞は増殖刺激に応答せず細胞分裂はしないが、代謝活動を行い、長期間に渡り生存できる。細胞老化は、細胞の異常増殖を防ぐことで、短期的にはがん化抑制機構として機能する。一方、老化細胞は特徴的な遺伝子発現パターンの変化を示し、炎症性サイトカイン等の分泌タンパク質を高発現することが知られる。この現象はSenescence-Associated-Secretory-Phenotype (SASP)と呼ばれ、がんや加齢性疾患の発症・進行に寄与する。加齢に伴い、生体内に老化細胞は蓄積し、老化細胞を除去すると、老化で見られる様々な表現型(認知症、筋肉の衰え、各種臓器の機能低下)が改善される。また、SASP因子には、ガンの生存や増殖を促進するものも含まれ、がん治療において老化細胞によるガン微小環境の形成が問題視されている。したがって、抗老化およびがん治療において、細胞老化の制御が新たな標的になりつつある。
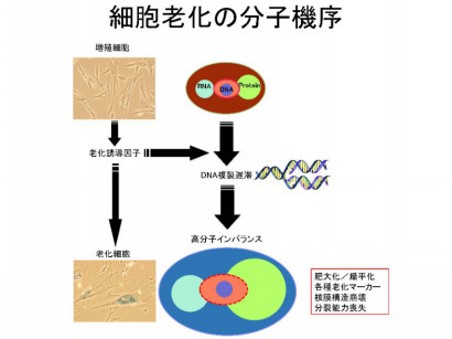
当研究室では、正常・不死化・がん化に関係なく、任意の細胞において細胞老化を誘導できることを報告してきた。細胞系によって老化形質は多様であるが、DNA複製の遅滞と細胞膨張は共通して観察される。これらの特徴から当研究室では、「細胞老化の不均衡増殖モデル」を提唱している。それは、細胞障害によるDNA複製の遅滞が細胞質タンパク質の異常な蓄積をもたらし、細胞膨張と核膨張を経て、核膜とヘテロクロマチン複合体が崩壊するという細胞老化の普遍的なモデルである。
現在、当研究室では、細胞老化の分子機構を解明する上で、
①細胞老化におけるタンパク質の異常な蓄積の役割
②細胞老化におけるヘテロクロマチンの役割 に着目し、研究を進めている。
①細胞老化におけるタンパク質の異常な蓄積の役割
研究室では、細胞質タンパク質合成の制限(正常な増殖には影響しない)が不均衡増殖を解消し、細胞老化を抑制することを見出した。また、この制限は、正常細胞の分裂寿命を顕著に延長しただけではなく、分裂を停止した老化細胞の増殖を再開させた。個体レベルにおいてもモデル生物である線虫(C. elegans)の平均寿命および最大寿命を延長させた。
今後の課題は、細胞質タンパク質合成の制限により、ヒトなどの高等動物の老化防止を実現できるかどうかである。そのためには、細胞質タンパク質合成をターゲットとした老化抑制剤の探索や開発を進める必要がある。また、タンパク質の摂取制限などの栄養学的見地からも老化防止の可能性を検討することも重要になる。
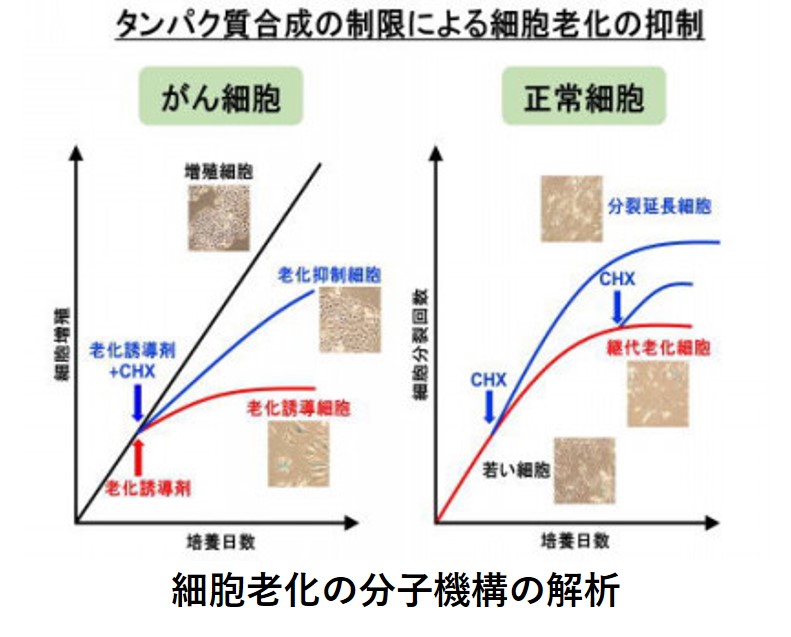
左図:がん細胞(HeLa)は老化せず増殖するが、老化誘導剤を投与すると数日で細胞老化形質を示す(細胞の肥大化・扁平化、老化マーカー発現、分裂停止など)。老化誘導剤とともに細胞質タンパク質合成阻害剤であるシクロへキシミド(CHX)をごく微量投与すると、細胞はほぼ正常に増殖を続けた。
右図:ヒト正常線維芽細胞(TIG)は培養を続けると老化する(継代老化)。シクロへキシミド(CHX)をごく微量投与すると、分裂寿命を顕著に延長しただけでなく、分裂を完全に停止した老化細胞の増殖が再開した。青い細胞は老化マーカーが発現していることを示す。Takauji et al., Sci. Rep. 2016
②細胞老化におけるヘテロクロマチンの役割
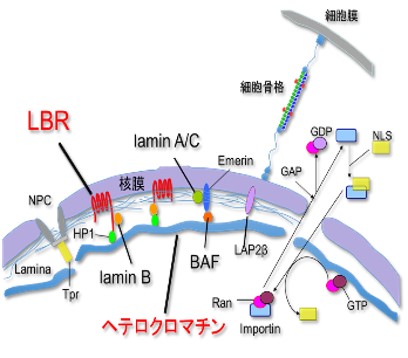
ヘテロクロマチンの大部分は、核膜タンパク質との相互作用を介して核膜内側に局在している。ヘテロクロマチンを核膜にアンカーする核膜タンパク質は多数知られるが、中心的役割を果たす核膜タンパク質はlamin A/Cとlamin B receptor(LBR)である。両者のノックアウトにより核膜近傍のヘテロクロマチンが消失することが報告されている(Solovei et al. Cell. 2014)。ヘテロクロマチンの変化は、大規模な遺伝子発現の変化を引き起こすことが予想されるが、それは老化細胞が示す、不可逆的な増殖停止やSASP因子の発現に寄与していると考えられる。
当研究室では、正常細胞とがん細胞を用いて、様々な方法で細胞老化を誘導し、共通して変化を示す核膜タンパク質を探索してきた。その結果、ヘテロクロマチン形成に重要な核膜タンパク質(lamin A/C, lamin B, LBR, LAP2β, Emerin, BAF, Nup153, Nup62, Nup214, Nup358)のうち、細胞老化に伴い、共通して核膜への局在を失ったのはLBRだけであった(Arai & En et al., BBRC, 2016)。また、LBRは細胞老化に伴いタンパク質レベルで減少することを見出した。
これまでの研究で、タンパク質の異常な蓄積が、小胞体ストレスおよびオートファジーによる分解系を介してLBRの局在変化・発現低下を引き起こす可能性を明らかにした(En et al., FEBS Open Bio, 2020)。さらに、LBRの機能低下が細胞老化に伴う増殖能の喪失に関与すること(Arai et al., Mech Ageing Dev., 2019)、LBRはSASP遺伝子領域と相互作用することで、SASP遺伝子の発現制御に重要な役割を果たすことを報告してきた(En et al., Exp Cell Res., 2020)。タンパク質合成の調節と同様に、LBRの機能調節は細胞老化の制御に有効な手段になると考えられる。
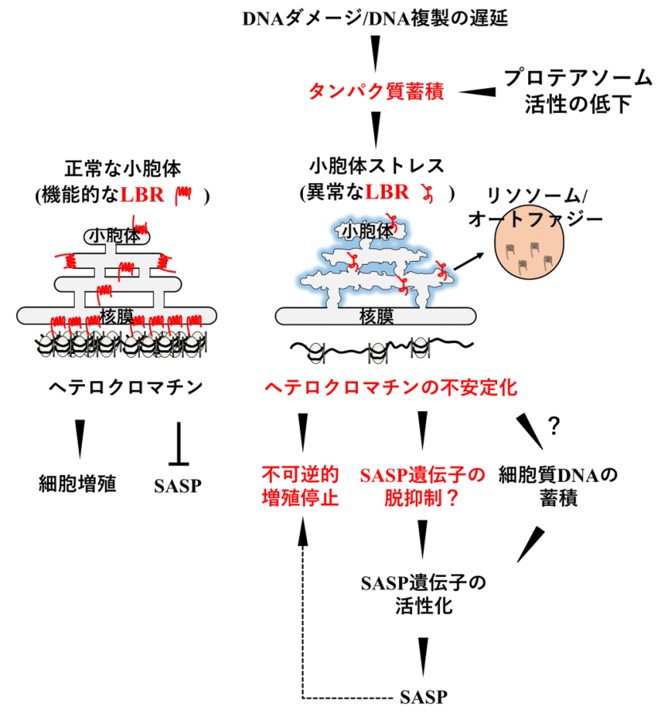
DNA複製の遅滞に伴う細胞質タンパク質の蓄積が、小胞体におけるタンパク質品質管理に負荷をかける。小胞体は核膜タンパク質の合成場所である。そのため、小胞体ストレスがヘテロクロマチン形成に重要な核膜タンパク質LBRの異常に繋がる。LBRが相互作用するヘテロクロマチンには、細胞老化関連遺伝子が含まれ、細胞老化を誘導する。
